1 国家基本药物
| 序号 | 基本药物目录序号 | 药品名称 | 剂型 | 规格 | 单位 | 零售指导价格 | 类别 | 备注 |
| 619 | 47 | 血栓通注射液 | 注射剂 | 0.175g:5ml | 支 | 22.4元 | 中成药部分 | *△ |
| 620 | 47 | 血栓通注射液 | 注射剂 | 0.07g:2ml | 支 | 11.1元 | 中成药部分 | |
| 621 | 47 | 血栓通注射液 | 注射剂 | 0.35g:10ml | 支 | 38.1元 | 中成药部分 | |
| 622 | 47 | 注射用血栓通 | 注射剂 | 0.25g(冻干粉针) | 支 | 61元 | 中成药部分 | *△ |
| 623 | 47 | 注射用血栓通 | 注射剂 | 0.1g(冻干粉针) | 支 | 30.2元 | 中成药部分 | |
| 624 | 47 | 注射用血栓通 | 注射剂 | 0.15g(冻干粉针) | 支 | 41.3元 | 中成药部分 |
注(化学药品和生物制品部分):
1、表中备注栏标注“*”的为代表品。
2、表中代表剂型规格在备注栏中加注“△”的,该代表剂型规格及与其有明确差比价关系的相关规格的价格为临时价格。
注(中成药部分):
2、表中备注栏加注“△”的剂型规格,及同剂型的其他规格为临时价格。
2 三七总皂苷药典标准
2.1 品名
Sanqi Zongzaogan
NOTOGINSENG TOTAL SAPONINS
2.2 来源
本品为五加科植物三七Panax notoginseng (Burk) F.H. Chen.的主根或根茎经加工制成的总皂苷。
2.3 制法
取三七粉碎成粗粉,用70%的乙醇提取,滤过,滤液减压浓缩,滤过,过苯乙烯型非极性或弱极性共聚体大孔吸附树脂柱,用水洗涤,水洗液弃去,以80%的乙醇洗脱,洗脱液减压浓缩,脱色,精制,减压浓缩至浸膏,干燥,即得。
2.4 性状
本品为类白色至淡黄色的无定形粉末;味苦、微甘。
2.5 鉴别
取本品,照[含量测定]项下的方法试验,供试品色谱图中应呈现与三七总皂苷对照提取物中三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd色谱峰保留时间相同的色谱峰。
2.6 检查
2.6.1 干燥失重
取本品,在80℃干燥至恒重,减失重量不得过5.0%(2010年版药典一部附录Ⅸ G)。
2.6.2 炽灼残渣
不得过0.5%(2010年版药典一部附录Ⅸ J)。
2.6.3 溶液的颜色
取本品适量,加水制成每1ml含三七总皂苷25mg的溶液,与黄色4号标准比色液(2010年版药典一部附录ⅪA)比较,不得更深。有关物质(注射剂用)
2.6.4 蛋白质
取本品50mg,加水1ml溶解,依法检查(2010年版药典一部附录Ⅸ S),应符合规定。
2.6.5 鞣质
取本品50mg,加水1ml溶解,依法检查(2010年版药典一部附录Ⅸ S),应符合规定。
2.6.6 树脂
取本品250mg,加水5ml溶解,依法检查(2010年版药典一部附录Ⅸ S),应符合规定。
2.6.7 草酸盐
取本品200mg,加水4ml溶解,依法检查(2010年版药典一部附录Ⅸ S),应符合规定。
2.6.8 钾离子
取本品0.1g,缓缓炽灼至完全炭化,再在500~600℃炽灼使完全灰化,依法检查(2010年版药典一部附录Ⅸ S),应符合规定。
2.6.9 重金属及有害元素
照铅、镉、砷、汞、铜测定法(2010年版药典一部附录Ⅸ B)测定,铅不得过百万分之五;镉不得过千万分之三;砷不得过百万分之二;汞不得过千万分之二;铜不得过百万分之二十。
2.6.10 树脂残留
照残留溶剂测定法(2010年版药典二部附录Ⅷ P第二法)测定。
2.6.11 色谱条件与系统适用性试验
以键合/交联聚乙二醇为固定相的石英毛细管柱(柱长为30m,内径为0.25mm,膜厚度为0.25μm);柱温为程序升温,起始温度为60℃,保持16分钟,再以每分钟20℃升温至200℃,保持2分钟;用氢火焰离子化检测器检测,检测器温度300℃;进样口温度240℃;载气为氮气,流速为每分钟1.0ml。顶空进样,顶空瓶平衡温度为90℃,平衡时间为30分钟。理论板数以邻二甲苯峰计算应不低于40000,各待测峰之间的分离度应符合规定。
2.6.12 对照品溶液的制备
精密称取正己烷、苯、甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯和二乙烯苯对照品适量,加N,N-二甲基乙酰胺制成每1ml中分别含20μg、4μg、20μg、20μg、20μg、20μg、20μg、20μg的溶液,作为对照品贮备液。精密吸取上述贮备液2ml,置50ml量瓶中,加25% N,N-二甲基乙酰胺溶液稀释至刻度,摇匀,精密量取5ml,置20ml顶空瓶中,密封,即得。
2.6.13 供试品溶液的制备
取本品约0.1g,精密称定,置20ml顶空瓶中,精密加入25% N,N-二甲基乙酰胺溶液5ml,密封,摇匀,即得。
2.6.14 测定法
分别精密量取顶空气体1ml,注入气相色谱仪,测定,即得。
本品含苯不得过0.0002%,含正己烷、甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯和二乙烯苯均不得过0.002%(供注射用)。
2.6.15 异常毒性
取本品,加氯化钠注射液制成每1ml含三七总皂苷5.0mg的溶液,作为供试品溶液。取体重为17~20g小鼠5只,在4~5秒内每只小鼠注射供试品溶液0.5ml于尾静脉中,全部小鼠在给药后48小时内不得有死亡;如有死亡,另取体重为18~19g的小鼠10只复试,全部小鼠在48小时内不得有死亡(供注射用)。
2.6.16 热原
取本品,加氯化钠注射液制成每1ml含50mg的溶液,依法检查(2010年版药典一部附录XIII A),剂量按家兔体重每1kg注射0.5ml,应符合规定(供注射用)。
2.7 指纹图谱
取本品,照[含量测定]项下的方法试验,记录色谱图。
按中药色谱指纹图谱相似度评价系统,供试品指纹图谱与对照指纹图谱经相似度计算,5分钟后的色谱峰,其相似度不得低予0.95。
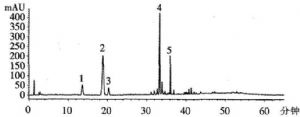
对照指纹图谱
峰1:三七皂苷R1 峰2:人参皂苷Rg1 峰3:人参皂苷Re峰4:人参皂苷Rb1 峰5:人参皂苷Rd
2.8 含量测定
照高效液相色谱法(2010年版药典一部附录Ⅵ D)测定。
2.8.1 色谱条件与系统适用性试验
以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相A,以水为流动相B,按下表中的规定进行梯度洗脱;流速每分钟为1.5ml;检测波长为203nm;柱温25℃。人参皂苷Rg1与人参皂苷Re的分离度应大于1.5。理论板数按人参皂苷Rg1峰计算应不低于6000。
时间(分钟) | 流动相A(%) | 流动相B(%) |
0~20 | 20 | 80 |
20—45 | 20→46 | 80→54 |
45~55 | 46→55 | 54→45 |
55~60 | 55 | 45 |
2.8.2 对照提取物溶液的制备
取三七总皂苷对照提取物适量,精密称定,加70%甲醇溶解并稀释制成每1ml含2.5mg的溶液,即得。
2.8.3 供试品溶液的制备
取本品25mg,精密称定,置10ml量瓶中,加70%甲醇溶解并稀释至刻度,摇匀,即得。
2.8.4 测定法
分别精密吸取对照提取物溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。
本品按干燥品计算,含三七皂苷R1( C47H80O18)不得少于5.0%、人参皂苷Rg1(C42H72O14)不得少于25.0%、人参皂苷Re(C48H82O18)不得少于2.5%、人参皂苷Rb1(C54H92O23)不得少于30.0%、人参皂苷Rd(C48H82O18)不得少于5.0%,且三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd总量不得低于75%(供口服用)或85%(供注射用)。
2.9 贮藏
2.10 制剂
口服制剂
2.11 版本
《中华人民共和国药典》2010年版
3 三七总皂苷介绍
3.1 药品名称
3.2 英文名称
Panax Notoginsenosidum
3.3 别名
血栓通;田七人参总皂苷;田七人参总皂甙;血塞通;Panax Pseudoginseng
3.4 分类
3.5 剂型
针剂:100mg(2ml),250mg(5ml)
3.6 三七总皂苷的药理作用
系由三七(Panaxnotoginreng)的叶中分离提取的三七总苷制成的注射剂,具有活血化淤、通脉活络以及抑制血小板聚集和增加脑血流量的作用。对实验性血栓形成,抑制率达92.13%,且能显著降低血液粘度及纤维蛋白质含量,并能使全血凝固时间、凝血酶原时原时间、凝血酶时时间显著延长。
3.7 三七总皂苷的药代动力学
急性毒性试验中,小鼠灌胃给药的半数致死量(LD50)为16020±1508mg/kg,皮下给药为594.52±15.54mg/kg。亚急性毒性试验中,家兔一天静脉注射三七总皂苷110mg/kg,24天后对血象、肝肾功能等未见明显影响,与对照组比较,其心、肝、肾、肠、肾上腺等实质性器官亦未见明显的形态学改变。
3.8 三七总皂苷的适应证
缺血性脑血管疾病、脑出血后遗症瘫痪以及视网膜中央静脉阻塞、眼前房出血、青光眼等,也可用于治疗病毒性肝炎。
3.9 三七总皂苷的禁忌证
(尚不明确)
3.10 注意事项
不可用作滴眼。
3.11 三七总皂苷的不良反应
3.12 三七总皂苷的用法用量
1.静注:每次200~400mg,每天1次,以25%~50%葡萄糖注射剂40~60ml稀释后静脉缓推。
2.静脉滴注:每次200~400mg,每天1次,以10%葡萄糖注射剂250~500ml稀释后静脉滴注。10~15天为1个疗程。
3.肌注:每次100~200mg,每日1~2次。
3.13 药物相互作用
(尚不明确)